Toma de muestra
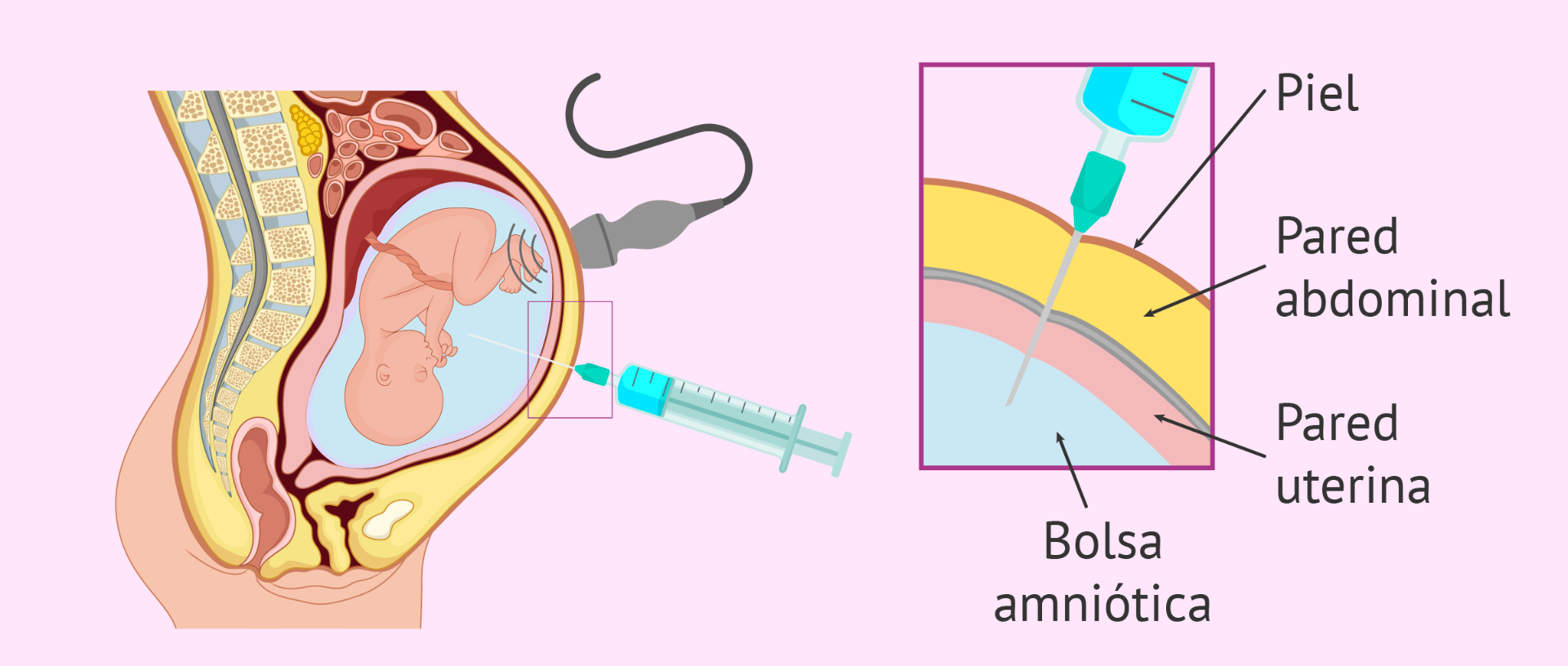
La amniocentesis es un procedimiento de diagnóstico prenatal invasivo de segundo trimestre, descrito inicialmente en 1966 por Steele y Berg. Consiste en la inserción de una aguja espinal a través de la pared abdominal, pared uterina y la cavidad amniótica bajo guía ecográfica continua, de forma que se pueda aspirar una muestra del líquido amniótico.
Consideraciones previas
- Edad gestacional: Es un procedimiento que se realiza a partir de la semana 16 de gestación, no podrá realizarse antes de las 15+0 semanas (early amniocentesis) puesto que representa un riesgo aumentado de problemas ortopédicos (talipes), complicaciones respiratorias neonatales, en conjunto con una mayor tasa de fallo del cultivo.
- Consentimiento informado: Se debe informar a la gestante sobre el procedimiento, las complicaciones asociadas y las medidas preventivas que pueden tomarse.
- Conocimiento del RhD: Si la gestante es RhD negativa se iniciará gammaglobulina anti-D antes de cumplir las 72 h post procedimiento, excepto si se ha realizado un genotipado prenatal no invasivo, con resultado de feto RhD negativo. Como norma general, no se tendrá en cuenta el RhD de la pareja.
- Conocimiento de serologías: VIH, VHB y VHC. Las serologías positivas no se consideran una contraindicación absoluta para el procedimiento y deberá valorarse cada caso de manera individual.
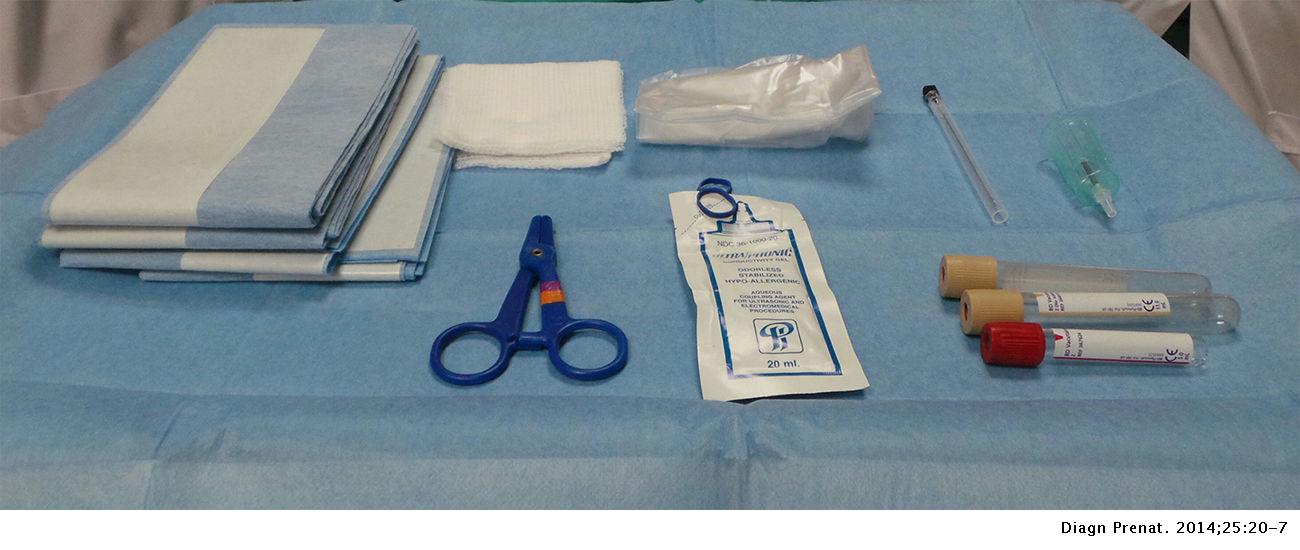
Materiales y personal
Los protocolos locales deben determinar si la ecografía durante el procedimiento debe ser realizada por la persona que inserta la aguja (técnica de un operador) o por un asistente ecografista responsable de la aspiración (técnica de 2 operadores). En cuanto a instrumental, los requerimientos mínimos son:
- Camilla o mesa de exploración ginecológica;
- Ecógrafo;
- Gasas estériles y antiséptico (clorhexidina);
- Funda estéril para la sonda ecográfica;
- Gel estéril;
- Aguja de calibre 22G (0,7 cm de diámetro, 9 cm de largo) o 20G;
- Jeringa de 20ml o Tubos Vacutainer® (dependiendo del método pauteado)
Procedimiento Amniocentesis abdominal
1. Se debe colocar a la gestante en posición de decúbito supino (acostada de espalda).
2. La evaluación ecográfica previa a la punción debe recorrer la totalidad de la cavidad uterina en el abdomen de la madre, con el transductor completamente horizontal, para definir la ubicación de la placenta, el pool máximo de líquido amniótico, la posición y el patrón de movimientos fetales. No se debe ladear la sonda del plano perpendicular; de lo contrario se estará "enfocando" un campo que se halla situado debajo o encima de la sonda.
3. El operador y el asistente deben realizarse un lavado de manos con antiséptico (clorhexhidrina o esterilium) y colocarse guantes estériles.
4. Se procede a la aseptización de la piel del área abdominal expuesta.
5. Si el pool de líquido amniótico donde debemos acceder está situado en el hemiabdomen izquierdo, la sonda debe lateralizar manteniéndose en el mismo plano transverso hacia el hemiabdomen derecho, de manera que forme un ángulo de unos 45° con el plano sagital de la madre y el útero.
6. La punción tiene 4 fases: la punción en la piel de la gestante, la punción del útero, la entrada en la cavidad amniótica y el punto donde se detiene el avance de la aguja.
- Punción abdominal. En el avance de la aguja entre la piel y el útero es importantísimo evitar la punción de asas intestinales no visualizadas por un ángulo «muerto» de visión ecográfica nula debido a un error en la inclinación lateral de la sonda (podría causar corioamnionitis y conducir a una sepsis materna y eventualmente a su muerte)
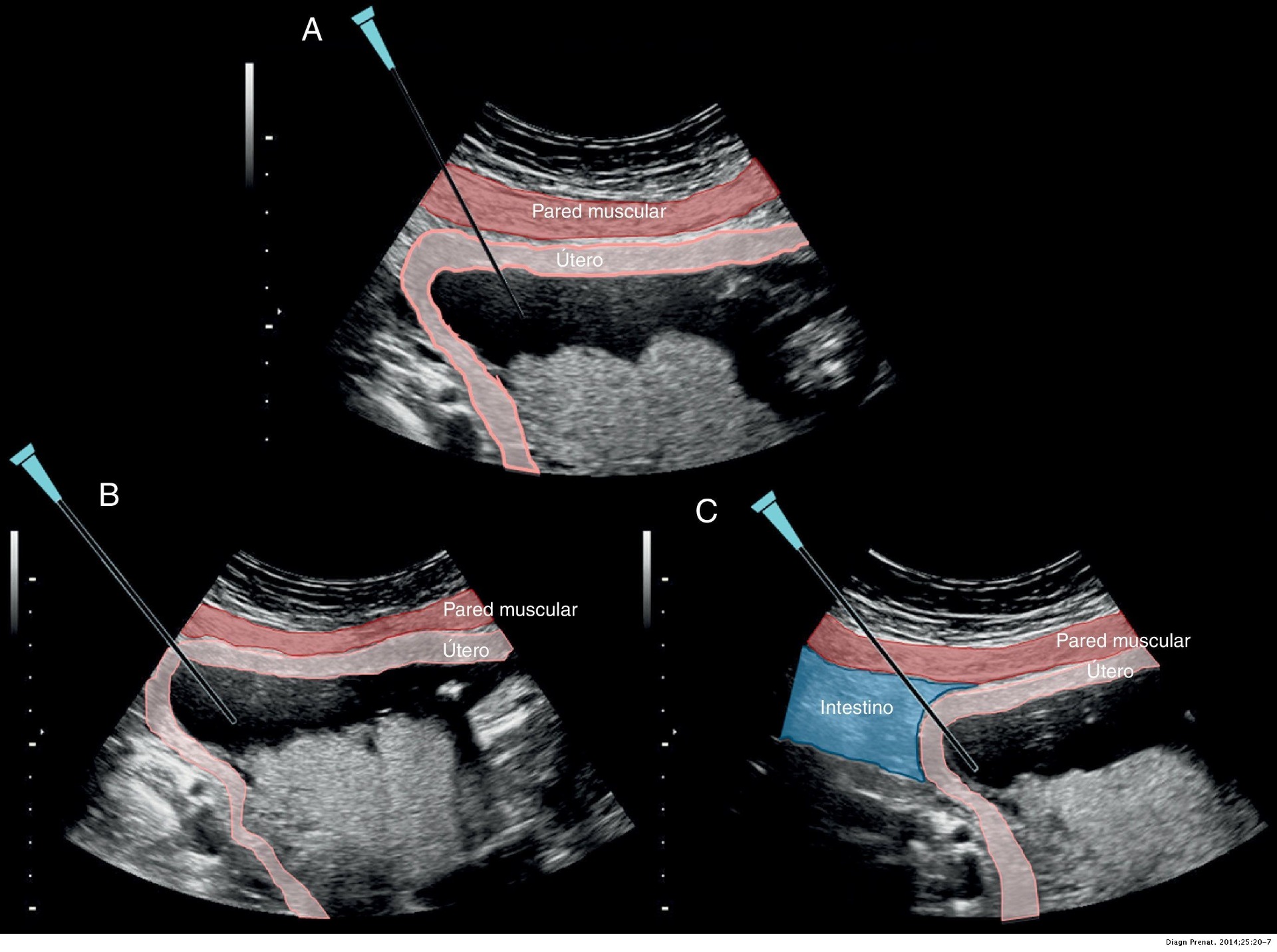
Figura 2. Punción de la pared abdominal materna hasta llegar al útero. A) Manera correcta con visualización de todo el trayecto de la aguja. B) Ángulo «muerto». C) Error por punción de asas intestinales - Amniocentesis: guía práctica
- Punción uterina. La punción del útero puede ser dolorosa porque está recubierto por peritoneo. Debe confirmarse la orientación inicial de la aguja antes de pinchar ya que después será demasiado tarde para rectificar.
- Entrada en cavidad amniótica. Una localización parcial de la aguja puede conllevar la punción de la pared posterior del útero y la salida de la aguja por la parte posterior. Este paso debe realizarse con un movimiento decidido para evitar el tenting (imagen de tienda de campaña) de las membranas que impida una entrada real en la cavidad amniótica y no se pueda extraer líquido.
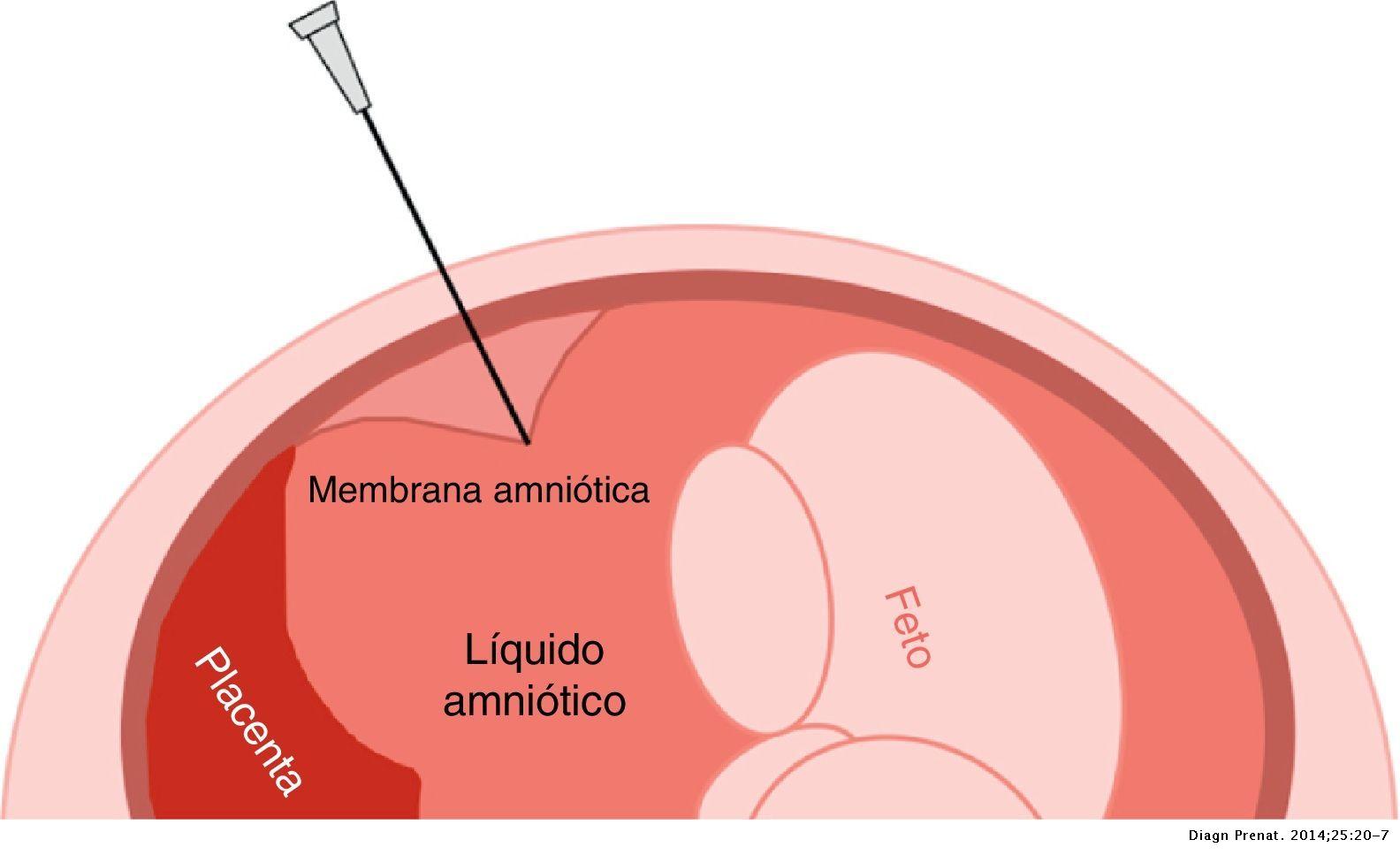
- Detención del avance de la aguja. Dentro de la cavidad amniótica no se detiene el avance de la aguja hasta 1-2 cm antes de llegar a la pared posterior, para evitar que una contractura de la pared anterior nos disloque la aguja y para que la punta de la aguja no "apunte" al feto y así evitar que en sus movimientos se pinche.
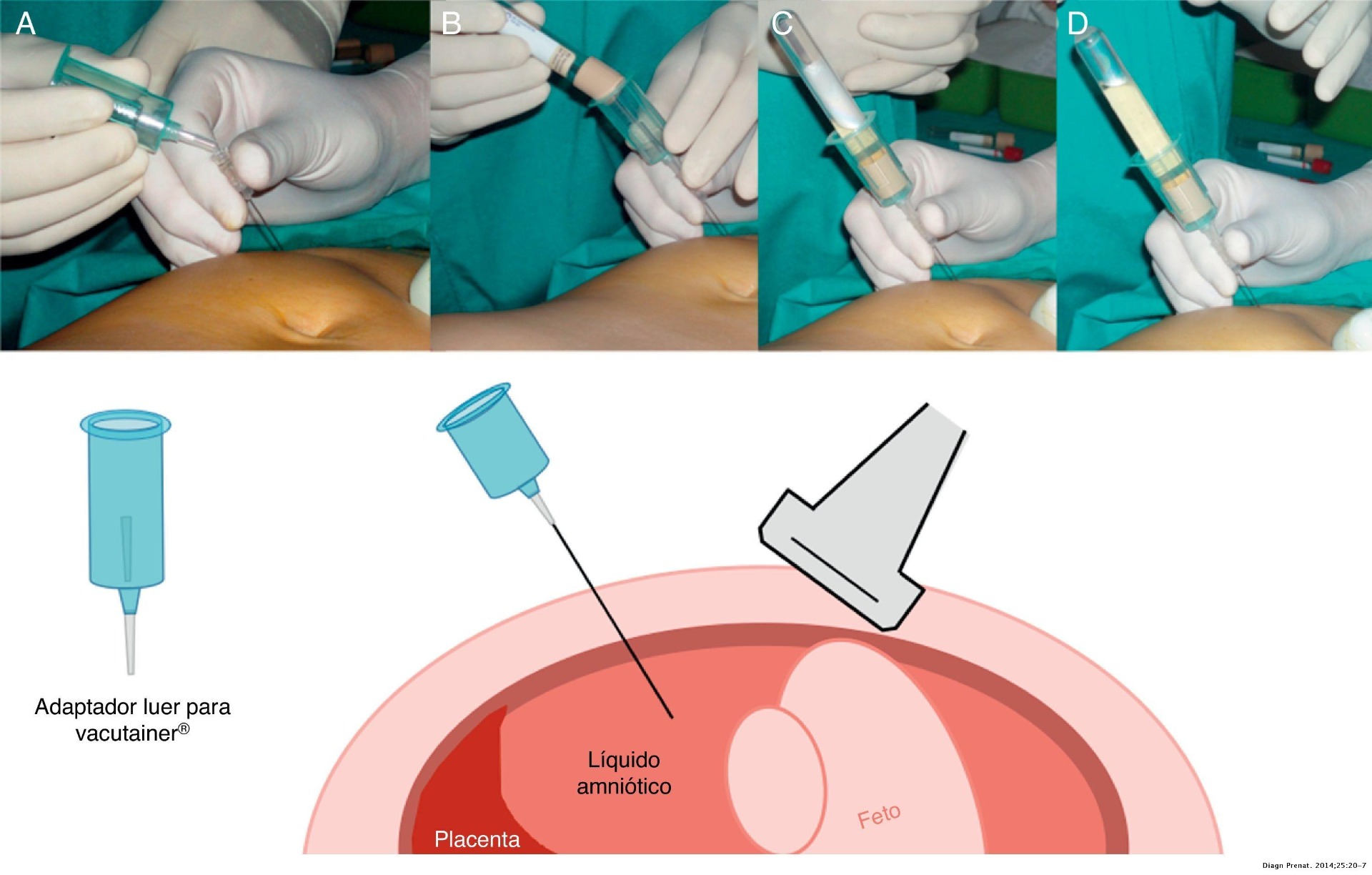
7. Aspiración del líquido amniótico. Se deben obtener unos 10 - 20ml de líquido amniótico, idealmente sin contaminación con células hemáticas maternas. Para evitarlo, antiguamente se desechaban los 2 primeros ml que se enviaban a bioquímica para la determinación de alfafetoproteína. En la actualidad se ha abandonado su determinación sistemática en todas las amniocentesis.
8. Post-obtención, debe confirmarse la viabilidad fetal y comprobarse que no exista sangrado en el punto de entrada de la aguja en la cavidad uterina.
- En caso de una punción fallida, si se decide retirar la aguja y localizar un nuevo punto de entrada, se debe realizar un cambio de aguja.
- Si tras 2 intentos de punción uterina no se ha logrado obtener una cantidad mínima de líquido amniótico adecuada para el análisis, una nueva punción deberá demorarse hasta una semana. Si solo se obtiene 1ml, se puede recurrir a tener un resultado exclusivamente mediante una QF-PCR.
- Alternativamente puede hacerse a través de la vagina (Amniocentesis vaginal, también bajo ecografía continua), aunque se prefiere la amniocentesis transabdominal, debido a que la vaginal puede contaminar el líquido con células vaginales y bacterias propias de la zona.
- El procedimiento de Amniocentesis conlleva un riesgo de pérdida fetal de aproximadamente el 0,5% cuando se realiza en el segundo trimestre, además de un riesgo menor de otras complicaciones, como la pérdida de líquido amniótico (0,3%), hemorragia placentaria, infección intraamniótica, hematoma de la pared abdominal o traumatismo fetal.
Conservación y transporte
- Una vez aspirado el líquido amniótico, debe transferirse de forma inmediata a los tubos (al menos uno sin anticoagulante para estudio físico-químico y uno con EDTA para estudio citológico) o contenedores plásticos estériles (análisis microbiológico) para su transporte al laboratorio con la salvedad de que deben ir protegidos de la luz (El ISP recomienda utilizar contenedores de color ámbar o recubrirlos con papel aluminio para prevenir la foto oxidación de la bilirrubina).
- El transporte al laboratorio debe realizarse lo más pronto posible posterior a la extracción.
- Las muestras para estudios de fosfolípidos deben transportarse refrigeradas.
- La conservación a temperatura ambiente y sin centrifugar por largos periodos, puede provocar una pérdida importante de fosfolípidos (lecitina y esfingomielina) debido al metabolismo celular, por lo que todos los líquidos para análisis químicos deben ser centrifugados de forma inmediata.
- Si se planea almacenarlos por más de 24 hrs, será necesario congelarlos, aunque esto no es frecunte.

Tabla 4. Estabilidad de la muestra de líquido amniótico - Sistema de Información de Exámenes, SINFEX
Consideraciones posteriores
- Reposo relativo domiciliario de 24 h, permitiendo actividades de cuidado personal y desplazamientos por casa, ya que el reposo absoluto está contraindicado.
- Signos de alarma para acudir a Urgencias son el sangrado o pérdida de líquido amniótico, dolor abdominal intenso o fiebre igual o superior a 38°C
- Se recomienda realizar un control ecográfico una semana después de la amniocentesis.

